Wissenswertes zum Thema Wasserstoff und Brennstoffzellen
1 Einleitung: Rettet Wasserstoff das Klima?
2 Energieversorgung von der Steinzeit bis heute
- 2 Energieversorgung von der Steinzeit bis heute
- 2.1 Der Energiebedarf wächst
- 2.2 Heutige Energiequellen
- 2.3 Grenzen der heutigen Energieversorgung
- 2.4 Ausweg Atomenergie?
- 2.5 Das richtige Timing: Speicher und Lastmanagement
- 2.6 Zukunftsszenarien für die Energiewende
- 2.7 Der Beginn der solaren Wasserstoffwirtschaft
- 2.8 Die Nationale Wasserstoffstrategie
3 Wasserstoff und seine Eigenschaften
4 Gewinnung von Wasserstoff
- 4 Gewinnung von Wasserstoff
- 4.1 Zukünftiger Wasserstoffbedarf
- 4.2 Herstellungsprozesse im Überblick
- 4.2.1 Die Elektrolyse: Hoffnungsträger für grünen Wasserstoff
- 4.2.1.1 Die Elektrolyse: Hoffnungsträger für grünen Wasserstoff
- 4.2.2 Reformierung von Kohlenwasserstoffen
- 4.2.2.1 Dampfreformer
- 4.2.2.2 Partielle Oxidation
- 4.2.2.3 Autothermer Reformer
- 4.2.3 Pyrolytische Prozesse auf Basis fester Kohlenwasserstoffe
- 4.2.4 Methanpyrolyse: Ein Traum in türkis
- 4.2.5 Kværner-Verfahren
- 4.2.6 Mikrobiologische Herstellung: Von Natur aus grün
- 4.2.7 Dissoziation: Wasserstoff aus dem Solarturm
- 4.2.8 Methanhydrat: Wasserstoff aus der Tiefsee?
- 4.3 Reinigung
- 4.4 Herstellungskosten
5 Speicherung von Wasserstoff
6 Transporte
7 Tankstellen-Infrastruktur
9 Brennstoffzelle
10 Einsatzgebiete
11 Wasserstoffmotor
12 Wasserstoff für die Industrie
13 Katalytischer Brenner
14 Kosten der Wasserstofftechnologien
15 Fazit und Ausblick
16 Anhang
17 Literatur

Teil 4.3.2 | Wichtige Reinigungsverfahren im Überblick
4.3.2.1 Druckwechseladsorption
Das am weitesten verbreitete Reinigungsverfahren ist das so genannte PSA-Verfahren (Pressure Swing Adsorption = Druckwechseladsorption). In PSA-Anlagen können mehrere Hunderttausend Normkubikmeter Wasserstoff pro Stunde gereinigt werden. Die PSA ist ein etabliertes Verfahren, um Gasgemische zu trennen. Sie nutzt dafür die unterschiedlichen Adsorptionseigenschaften der Gase an einem Feststoff. Sie läuft hoch automatisiert und ist auch im Teillastbetrieb möglich. Es lässt sich damit Wasserstoff bis zur Reinheitsstufe 6.0 gewinnen.
4.3.2.2 Entschwefelung
Fossile Brennstoffe enthalten meist Schwefel. Nutzt man sie zur Wasserstoffgewinnung, muss man den Schwefel entfernen. In Brennstoffzellen würde er sonst die edelmetallhaltigen Katalysatoren angreifen. Wenn man den Wasserstoff per Elektrolyse gewinnt, ist gar kein Schwefel enthalten und man kann sich daher die Entschwefelung sparen.
Für Niedertemperatur-PEM-Brennstoffzellen gilt beispielsweise ein maximaler Schwefelgehalt von 0,1 ppm. Für den Entschwefelungsprozess von Erdgas können Aktivkohle oder Zinkoxid (ZnO) mit oxidischen Zusätzen benutzt werden. Dabei handelt es sich jeweils um Feststoffe, an denen sich die Schwefelverbindungen anlagern.
Eine Alternative sind sogenannte Biowäscher. Dabei wird das Gas durch einen Behälter geleitet, der mit sogenannten Tropfkörpern aus Kunststoff gefüllt ist, die eine große Oberfläche haben. Über diese Tropfkörper rieselt mit Nährstoffen angereichertes Wasser. Auf den Tropfkörpern wächst ein Film aus Mikroorganismen, die den Schwefel aus dem Gas aufnehmen. Die Reaktion, die in so einem Behälter abläuft, lautet:
H2S + 2 O2 → H2SO4 (Sulfat)
Diese Biowäscher können den Schwefelgehalt von 6.000 ppm auf 50 bis 100 ppm reduzieren. Sind noch niedrigere Konzentrationen notwendig, kann zusätzlich ein chemischer Wäscher eingesetzt werden, der den Schwefelgehalt mithilfe von Natronlauge weiter reduziert. Je nachdem, wie hoch die Ausgangskonzentration ist, kann der Anteil bis unter die Nachweisgrenze verringert werden (von 100 ppm auf 0 ppm).
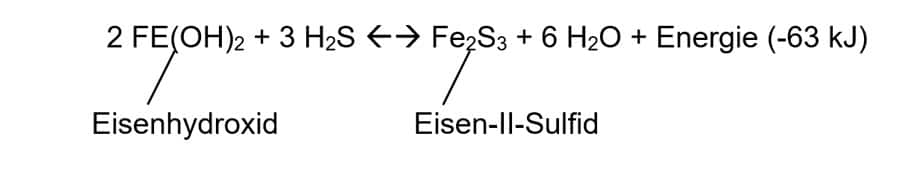
Ein weiteres Verfahren für die Entschwefelung ist das Eisenerz-Festbett-Verfahren, bei dem Eisenhydroxid verwendet wird:
4.3.2.3 Verflüssigung
Eine andere Möglichkeit der Reinigung ist die Verflüssigung. Wie bei einer Art umgekehrtem Destillationsprozess werden hierbei die unterschiedlichen Bestandteile bei verschiedenen Temperaturen abgetrennt. Da der Energieaufwand für die Verflüssigung sehr hoch ist, wird sie nicht als eigenständiges Reinigungsverfahren eingesetzt. Der Reinigungseffekt wird vielmehr dann genutzt, wenn die Verflüssigung ohnehin nötig ist, zum Beispiel für die Anlieferung zu H2-Tankstellen oder auch bei mit Flüssigwasserstoff betriebenen Trucks.
Zum ersten Mal gelang James Dewar die Verflüssigung von Wasserstoff, und zwar im Jahr 1898. Zur Vorkühlung verwendete er flüssige Luft, mit der er verdichteten Wasserstoff zunächst bis auf -205 °C abkühlte. Mithilfe eines H2-Drosselkreislaufs verringerte er die Temperatur noch weiter bis auf -253 °C. Großtechnischen Nutzen erlangte die Wasserstoffverflüssigung Mitte des vergangenen Jahrhunderts in der Raumfahrt. Im Rahmen des Apollo-Programms wurde die erste große Verflüssigungsanlage gebaut. Für die Raumfahrt lohnte sich der große Aufwand, da hier die hohe Energiedichte eine große Rolle spielt. Der hohe Energieeinsatz zum Abkühlen und Verflüssigen des Gases rentiert sich allerdings nur bei solch speziellen Anwendungen oder bei größeren Mengen, weil somit insgesamt weniger Transporte notwendig sind.
Um Wasserstoff zu verflüssigen, muss eine Energiemenge eingesetzt werden, die fast 30 Prozent der im Wasserstoff enthaltenen Energie entspricht. Theoretisch ist für diese Zustandsänderung ein Energiebedarf von 3,9 Kilowattstunden pro Kilogramm Wasserstoff erforderlich. In der Praxis sind es jedoch sieben bis zehn Kilowattstunden pro Kilogramm Wasserstoff, während der Energieinhalt nur 33 Kilowattstunden beträgt. Bezogen auf das Volumen entspricht dies 0,7 kWh/lH2. Die Verflüssigung wird daher nur für spezielle Anwendungen eingesetzt. Zu den Hauptabnehmern zählt die Halbleiterindustrie, die auf eine extrem hohe Reinheit des Gases angewiesen ist.
Im Gegensatz zu anderen Gasen lässt sich Wasserstoff nicht einfach durch hohen Druck verflüssigen. Die Verflüssigung von Wasserstoff erfolgt daher in der Regel im Claude-Prozess. Er unterteilt sich in folgende Arbeitsschritte:
• Verdichtung des Wasserstoffgases und Abführung der Verdichtungswärme
• Abkühlung des komprimierten Gases mithilfe von flüssigem Stickstoff (-196 °C)
• Entspannung und gleichzeitig Abkühlung einer Teilmenge in einer Expansionsmaschine
• Entspannung und weitere Abkühlung der Restmenge in einem Joule-Thomson-Ventil
Heutige Verflüssigungssysteme erreichen eine Kapazität von 50 bis 90 Tonnen Wasserstoff pro Tag. In Ingolstadt stand lange Zeit der einzige großtechnische Verflüssiger Deutschlands, der über eine Kapazität von vier Tonnen Wasserstoff pro Stunde verfügt. Weitere derartige Systeme in Westeuropa gibt es in Leuna, in Rozenburg bei Rotterdam, Niederlande, und in Waziers bei Lille, Frankreich.
4.3.2.4 Weitere Reinigungsverfahren
Je nach Bedarf können noch weitere Reinigungsverfahren angewendet werden. Dazu gehören:
• Hochtemperatur-Diffusion durch Metallmembranen
• Niedertemperatur-Diffusion durch Polymermembranen
• Kohlenstoffdioxidwäsche mit nachfolgender Methanisierung
• selektive, katalytische Oxidation von Kohlenstoffmonoxid an Platin- oder Rutheniumkatalysatoren